魚類の環境DNAをメタバーコーディングするためのユニバーサルプライマー(MiFish : マイフィッシュ)の開発者本人によるレビュー論文の和訳第三弾です。まだ、数パート続きます。研究課題を考える学生さんや新しく始める人などの仕事や研究の手助けになれば嬉しいです@しばた
MiFishメタバーコーディング:環境DNAおよびその他のサンプルから複数の魚種を同時に検出するためのハイスループットなアプローチ
MiFish metabarcoding: a high-throughput approach for simultaneous detection of multiple fish species from environmental DNA and other samples
目次
- Introduction
- 競合するUniversal PCRプライマーとの性能比較
- MiFishプライマーの分類学的最適化
- 望ましい実験室設定と改訂された実験プロトコルについて (今回はここ)
- 新しいバイオインフォマティクスパイプラインと参照データベース
- さまざまな水生環境での実証研究のレビュー
- 海の魚類群集
- 淡水の魚類群集
- 河口域の魚類群集
- MiFishプライマーを用いた新しい技術の開発
- 他の生物へのMiFishメタバーコーディングの応用
- バルクDNAサンプルへのMiFishメタバーコーディングの応用
- さいごに
- 感想
1,2章の内容はこちら
3章の内容はこちら
4. 望ましい実験室設定と改訂された実験プロトコルについて
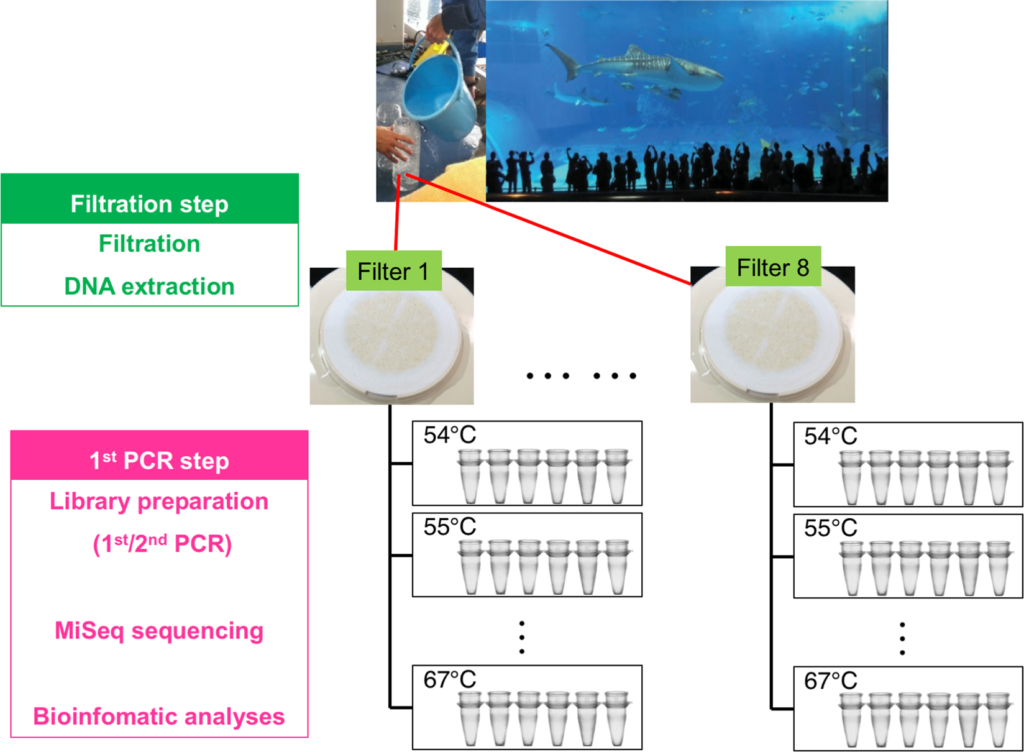
MiFishメタバーコーディングのための実験プロトコルは、沖縄の美ら海水族館の4つの水槽からの海水サンプルを使用して開発されました。
これらの水槽は周辺海域の魚類の種多様性を再現した、高密度環境であったため、これらの水槽からサンプリングされた環境DNAの濃度は高く、シーケンスのためのライブラリ調整は容易でした。
その後、沿岸・海洋水域、深海、河川、湖沼など様々な水域の幅広い緯度や標高で実証研究を行った結果、魚類の個体数密度が比較的まばらで、環境DNAの濃度が不明な環境水においては実験プロトコルが最適化されるべきであることが明らかになりました。
この結果を踏まえて著者らは実験プロトコルを改訂しました(環境DNA調査・実験マニュアル(Ver.2.2) 2020年4月3日) 。
また、環境DNAメタバーコーディングは外因性DNAの影響を非常に受けやすく、DNA抽出からライブラリの作成までのあらゆる実験ステップで汚染が起こり得ます。
以下は、MiFishメタバーコーディングのための最適な実験室設定と改訂された実験プロトコルについてまとめています。
実験環境について
環境DNAメタバーコーディングを成功させるための重要な課題の一つは、外因性DNAの影響を受けにくい実験環境を設定することです。
このような外因性DNAの供給源は様々なものが考えられ、偽陽性などは環境DNAメタバーコーディングに深刻な悪影響を及ぼします(Miya et al. 2015)。
外因性 DNA の影響を避けるために、環境DNAメタバーコーディングを行う実験室は以下の条件ごとに3 室に分けておく必要があります。
- 環境DNAの抽出 (Fig.9a)
- PCRの準備 (Fig.9b)
- PCRとPCR後の作業場 (Fig.9c)

(a)環境DNAの抽出 (b)PCRの準備 (c)PCRとPCR後の作業場
またキャリーオーバーなコンタミネーション(汚染)を避けるため、それぞれの部屋には個別に冷蔵庫、冷凍庫、遠心機、ラボコート、ピペット、Milli-Q ウォーターディスペンサーなどが必要となります(Sefers and Schmitz 2018)。
そして、各実験ステップに専用の部屋を用意して空間的に分離することに加えて、第3室 (PCRとPCR後の作業部屋) から他の部屋へアンプリコン (増幅されたDNA断片) を持ち込まないようにするために「一方通行ルール」を守る必要があります。
PCR増幅とチェックを行った後に、同日に同じ担当者が追加の環境DNAの実験を行わない、すべての機器は新品で未使用のものか、DNAフリーのものを使用する必要があります。
コンタミネーションフリーな環境DNAの実験に関する注意事項については、環境DNA学会のマニュアルを参照してください。
海水サンプルのろ過法の検討
海水サンプルへのプロトコルの最適化の中でMiFishプライマーが時折、PCRの増幅に失敗することがあります。
最も可能性の高い理由の1つとして、試料水中に十分な量の鋳型DNAが無かったことが考えられます(Miya et al.2016)。
特定分類群の環境DNA濃度は増幅前には不明ですが、大容量の水(> 1 L)をろ過することは、外洋や深海の生態系のような魚類の豊富さとバイオマスが乏しい環境から、より多くの環境DNAを収集するための簡単で効果的な方法です。

多くの魚類の環境DNAに関する研究(Rees et al. 2014)で使用されてきたディスクフィルターに比べて、カートリッジフィルター(Sterivex©; Sigma-Aldrich, St. Louis, MO, USA)は、以下の利点があります。
- 目詰まりする前に、より大きな水量に対応可能(Walsh et al. 2009)
- 個別包装なので無菌
- 実験ワークフローのいくつかのステップをフィルターハウジング内で実行可能(抽出の最初のステップ?)
これらの利点により、実験室由来の汚染の可能性を低減することができます。
SterivexとGF/Fフィルターの比較
Miya et al.2016はこれらの点を考慮して、Sterivexを用いた水試料のろ過の後、環境DNAを抽出するためのプロトコルを開発し、SterivexとGF/Fフィルターからの環境DNA抽出プロトコルを海水の水槽サンプルを使って比較しました。
MiFishメタバーコーディングによる解析を行ったところ、SterivexにはGF/Fフィルターを用いた場合より、検出された種数が有意に多いという結果になりました(Fig.10)。
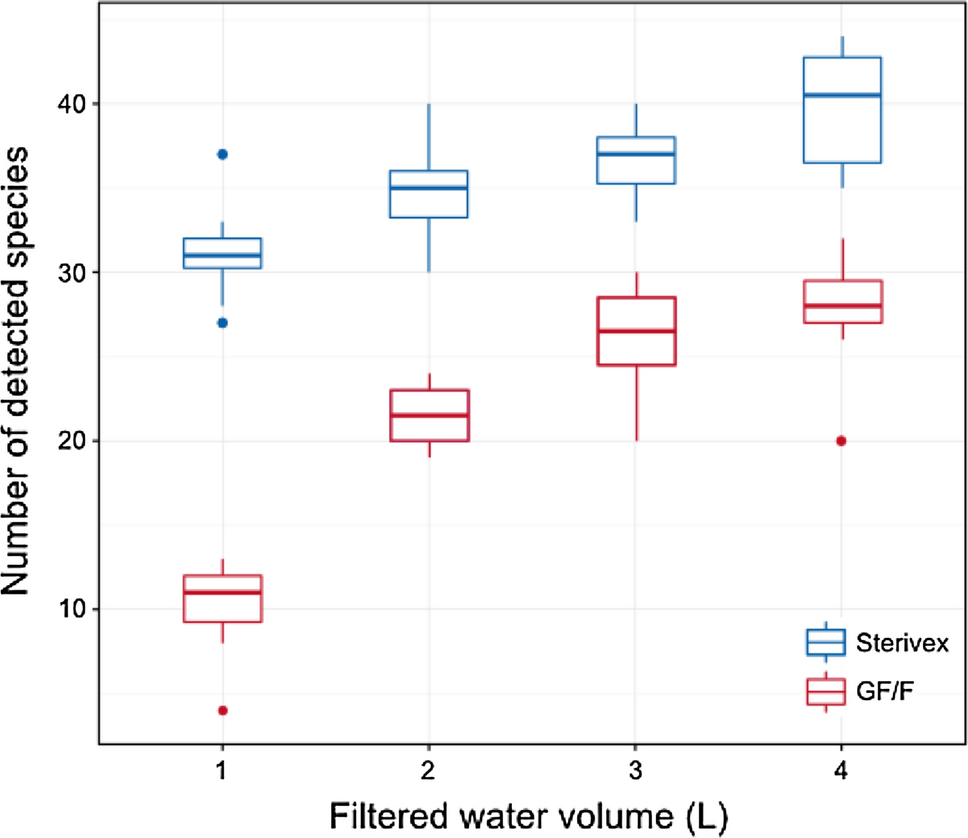
Sterivex: ステリベクス、GF/F: ガラスマイクロファイバーフィルター
この知見は、環境DNAの捕獲効率に対するろ過方法の効果を比較したその後の研究とも一致しています(Spens et al. 2016; Li et al. 2018; Capo et al. 2020)。
さらに最近では、Oka et al. 2020では、アスピレーターを用いた並列ろ過システムを開発し、14個の1L水サンプルを同時にろ過することが可能で、フィルターの目詰まりが起こりにくいことを示しました(論文 Fig.11)。

フィルターの目詰まりを起こしにくく、水サンプル1Lを1時間以内にろ過可能
現在、MiSeqのペアエンドシークエンシング (増幅されたDNAの両端から配列を解読) は、2段階のテイルドPCR (目的の部分の両端に識別プライマーをつける) アプローチを採用してライブラリを構築しています(Fig.1)。
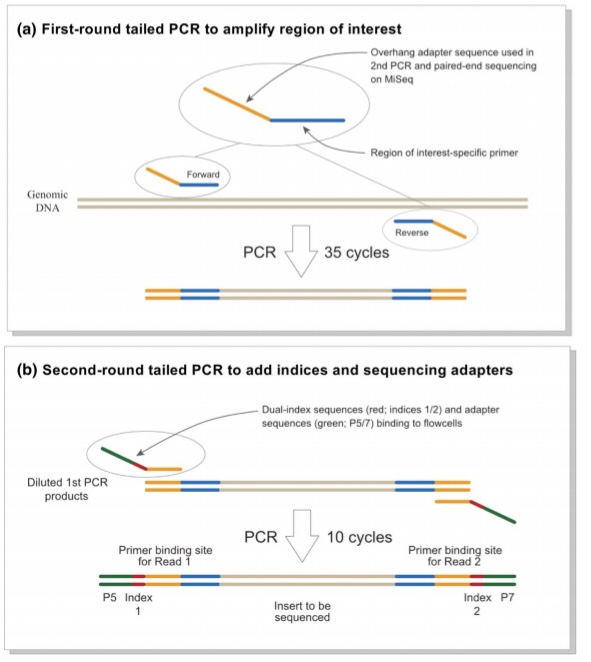
構築されたライブラリはプライマーと3つのアダプター配列を両端に介在させた魚に由来する超可変領域のみで構成されています(Fig.1b)。
しかし、MiSeqでの配列決定に失敗した場合、プライマーとアダプターの2つの領域の間のMiFish配列が欠落していたり、魚類以外の生物由来の配列に置換されていたりすることがあります。
このようなライブラリ作成の失敗を避けるためには、以下のことが重要です。
- スピンカラムまたはビーズを使用して、1st PCR産物を精製して、冗長なテールプライマーおよびプライマーダイマー(ハイブリダイズドテールプライマー分子)を除去する
- BioAnalyzerまたはTapeStationなどの自動電気泳動システムを使用して精製した第1回PCR産物を定量する
- 定量した第1回PCR産物を一定濃度(例えば、0.1 ng/μl)に希釈し、第2回PCR(第2回PCR)のテンプレートとして使用する
- ゲル電気泳動を使用して370 bp付近の第2回PCR産物をサイズ選択し、440 bp付近の余分なバンドを除去する
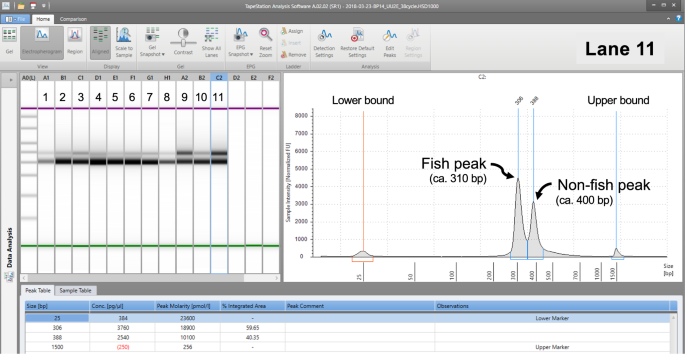
Gold et al. 2020によると440bp付近のバントは微生物の16S rRNA遺伝子に由来する産物と予測されています。
これらの余分なバンドは、河口や大都市近郊の湾岸部など、人為的な影響を受けやすい海域において、他の海域よりも顕著であることに注意が必要です。
これらの4つのステップを厳密に従うことで、MiFishメタバーコーディングの高品質なデータが保証され、ほとんどの魚類についてほぼ一定のリード数で結果が得られます。
1st PCRの繰り返し数について
環境DNAメタバーコーディングはフィールドサンプリング、実験室実験、およびバイオインフォマティクスパイプラインのステップで、種の検出エラーが発生しやすいことが知られています(Doi et al. 2019)。
Doi et al. 2020は、種組成が把握可能な水槽の水を用いて、PCRアニーリング温度(プライマーがDNAにひっつく温度)にともなう種の検出確率と、ろ過および1st PCR(同一のサンプルに対する抽出および増幅の繰り返し)における反復回数の影響を調べました。
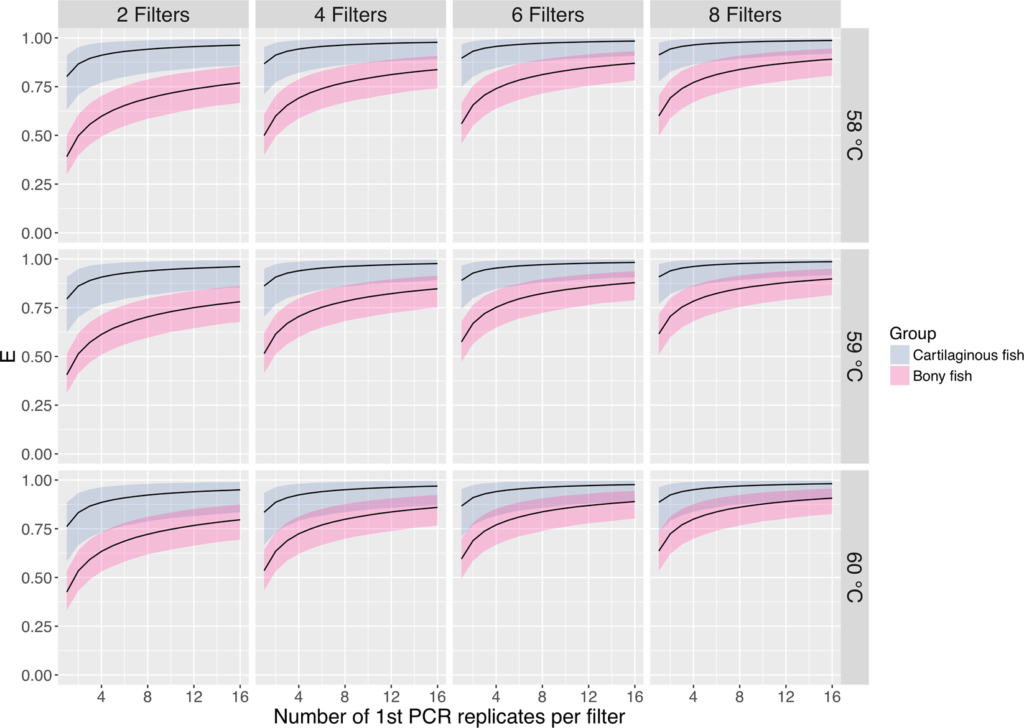
その結果、ろ過の複製数よりも1st PCR複製数を増加させる方が多種の検出において有利であることが分かりました。
したがって、高い検出確率を維持するために、複数の1st PCR 反復 (例えば、実験操作を容易にするために8反復) を選択することが良いといえます(Miya and Sado 2019a)。
この結果は、検出確率が高くない場合に少なくとも8回反復の1st PCRを行うことを提唱したFicetola et al. 2015と一致しています。
第三和訳おわり
Reference
- Walsh et al. 2009
Large volume (20L+) filtration of coastal seawater samples. - Rees et al. 2014
The detection of aquatic animal species using environmental DNA—a review of eDNA as a survey tool in ecology. - Ficerola et al. 2015
How to limit false positives in environmental DNA and metabarcoding? - Spens et al. 2016
Comparison of capture and storage methods for aqueous macrobial eDNA using an optimized extraction protocol: advantage of enclosed filter. - Sefers and Schmitz 2018
Molecular contamination and amplification product inactivation. Advanced techniques in diagnostic microbiology. - Li et al. 2018
The effect of filtration method on the efficiency of environmental DNA capture and quantification via metabarcoding. - Miya and Sado 2019a
Multiple species detection using MiFish primers. In: eDNA Method Standardization Committee (ed) Environmental DNA Sampling and Experiment Manual Version 2.1. - Capo et al. 2020
- Effects of filtration methods and water volume on the quantification of brown trout (Salmo trutta) and Arctic char (Salvelinus alpinus) eDNA concentrations via droplet digital PCR.
- Doi et al.2019
Evaluation of detection probabilities at the water-filtering and initial PCR steps in environmental DNA metabarcoding using a multispecies site occupancy model. - Gold et al.2020
FishCARD: Fish 12S California Current specific reference database for enhanced metabarcoding efforts - Oka et al. 2020
Environmental DNA metabarcoding for biodiversity monitoring of a highly-diverse tropical fish community in a coral-reef lagoon: Estimation of species richness and detection of habitat segregation