魚類の環境DNAをメタバーコーディングするためのユニバーサルプライマー(MiFish : マイフィッシュ)の開発者本人によるレビュー論文です。長いので数パートに分けて訳します。仕事や研究の手助けになれば嬉しいです@しばた
MiFishメタバーコーディング:環境DNAおよびその他のサンプルから複数の魚種を同時に検出するためのハイスループットなアプローチ
MiFish metabarcoding: a high-throughput approach for simultaneous detection of multiple fish species from environmental DNA and other samples
目次
- Introduction
- 競合するUniversal PCRプライマーとの性能比較 (今回はここまで)
- MiFishプライマーの分類学的最適化
- 望ましい実験室設定と改訂された実験プロトコルについて
- 新しいバイオインフォマティクスパイプラインと参照データベース
- さまざまな水生環境での実証研究のレビュー
- 海の魚類群集
- 淡水の魚類群集
- 河口域の魚類群集
- MiFishプライマーを用いた新しい技術の開発
- 他の生物へのMiFishメタバーコーディングの応用
- バルクDNAサンプルへのMiFishメタバーコーディングの応用
- さいごに
- 感想
1. Introduction
生物多様性のモニタリングが生態系の保全と生物資源の持続可能な利用に必要不可欠だと、ここ30年間で広く認識されてきました。
生物資源として水棲生態系から直接または間接的に大きな恩恵を受ける漁業は、利益を最大化するために単一種の漁獲量を最大化することに焦点をおき、生態系の構成要素の相互作用を無視することが多々ありました。

しかし、現在の漁業管理は世界的に、単一種に着目したアプローチから生態系全体を視野に入れるアプローチに転換してきています。
このような、「生態系に基づく漁業管理」の目的は漁業とそれを支える健全な生態系を維持することです。
生態系の健全性の評価は、必ず継続的なモニタリングが必要になります。それは環境の劣化や生物多様性の損失は生態系に経時的な変化が生じた場合にのみ知ることが出来るからです。
魚類のモニタリングを例にとると、魚類は世界中で32,000種以上が知られており、さらに、2005年から2014年の間に年間平均400種の新種が記載されています。未知種を多く含むこの分類群のモニタリングは、生息環境が水中である事から調査コストが大きく、分類学的な専門知識も必要です。
そういった手法論的な課題の解決法としては環境DNA分析が挙げられます。環境DNAは、水や沈殿物などの環境試料中に存在する生物由来の遺伝物質とよく定義されます。
環境DNAは一定量の水をろ過してフィルター上に捕集・抽出します。対象となる分類群用に作成されたユニバーサルなプライマーとハイスループットシーケンサー(Miseqやiseqなどの複数サンプルや複数種に由来するDNA配列を解読する機器のこと)を組み合わせた複数種の同時検出が可能となります(Fig.1)。
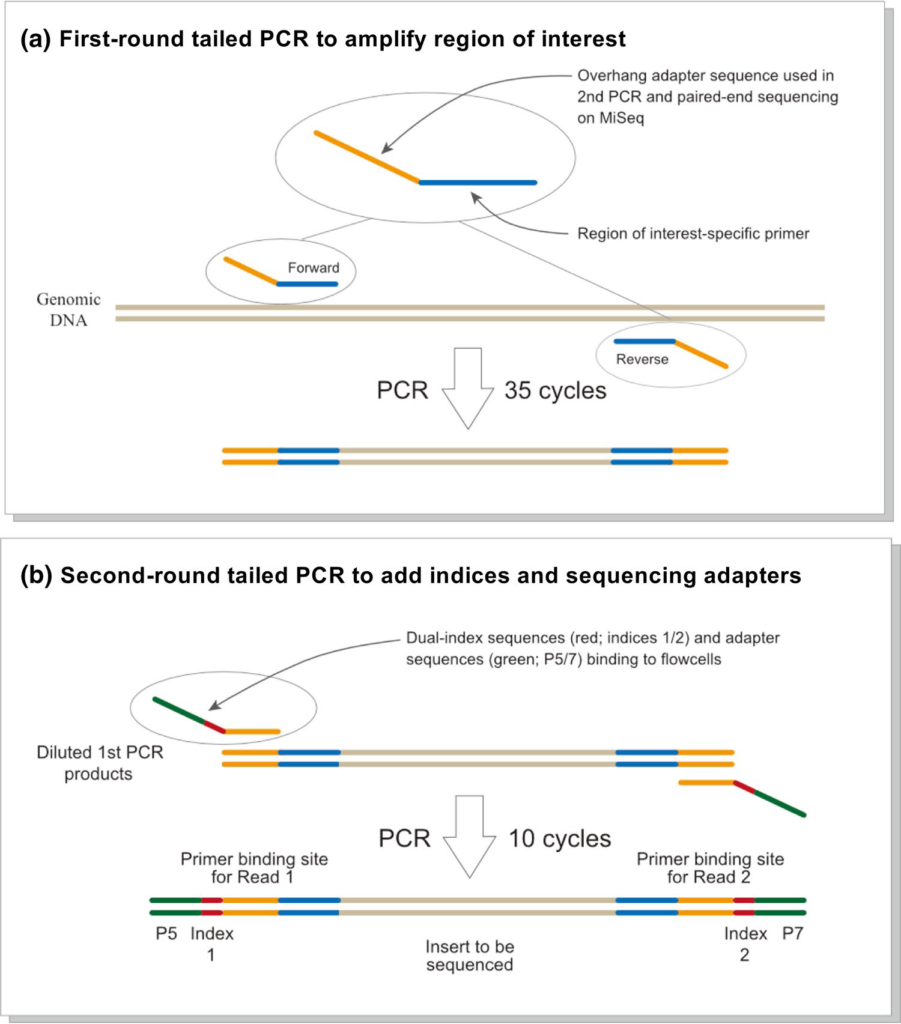
(From Miya et al. 2015をちょっと改変)
魚類を対象とするMiFishプライマーによるメタバーコーディング(ハイスループットシーケンサーを用いたDNA配列解読)は世界中に展開されています。DNAqua-Netは2016年からEUのCOST(CoOperation in Science and Technology)の支援を受けて、次世代の水棲生物モニタリング技術の開発を目的とするEU内外の39各国からなるネットワークです。
DNAqua-Netワーキンググループ(W3)は、DNAを用いたバイオモニタリングのためのフィールドおよびラボプロトコルを開発しており、2018年12月および2019年12月のDNAqua-NetニュースレターでMiFishメタバーコーディングについて議論、テストを行っています。
また、カリフォルニア海域周辺での研究では、生物多様性モニタリングの効率を向上させるべく、捕獲ベースのサンプリングの補完的手法としてMiFishメタバーコーディングを使用していくための検討が行われました。
内容の簡単な要約についてはこの記事を参考にしていただくといいかと思います。

日本においては、「河川水辺の国勢調査」の調査法にMiFishメタバーコーディングを利用する取り組みが始まっています(Kitagawa et al.2020)。

環境省生物多様性センターでは、絶滅の危機に瀕している淡水魚のモニタリングにMiFishメタバーコーディングの標準化を推進しています。
農林水産省では、今後5年間で対象となる種を50種から200種に拡大することを目標に、環境DNA分析を用いた太平洋全域の漁業資源のモニタリングを行う新たなプロジェクトを開始しました。
そしてここからは、日本だけでなく全世界で広く使われているMiFishプライマーについてレビューしていきます。
2. 競合するUniversal PCRプライマーとの性能比較
このセクションでは、MiFishプライマー開発の背景、プライマー性能のin silicoおよびin vitro比較に関する研究について紹介します。
MiFishプライマーの開発と有用性の検証に関しては過去の記事を参照ください。
MiFishプライマー配列の工夫
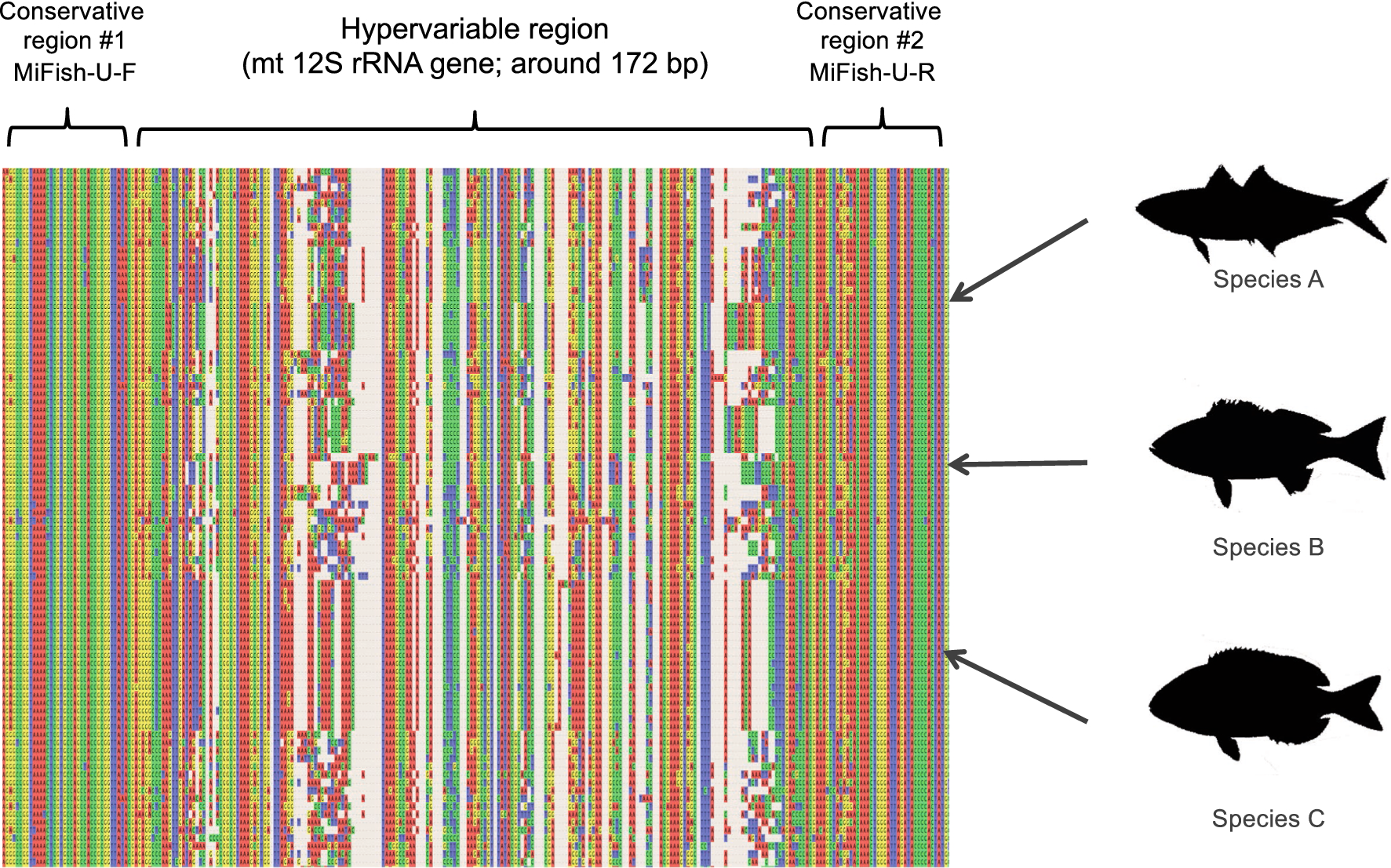
MiFishプライマーは種を見分ける領域(Hypervariable region)であるミトコンドリアDNA 12s rRNA上の163bp-185bp(平均172bp)を挟むように作られています(論文 Fig.4)。
また、MiFishプライマーは縮重塩基を使わずに、環境中に浮遊するDNAにプライマーがアニーリングしやすくするために以下の「技術的なコツ」を考慮して作成しています。
- プライマーの3ʹ末端にG / Cを含む(この位置でのプライマーとテンプレートのアニーリングが強化される)
- 3ʹ末端のGs(Gの連続)またはCs(Cの連続)の文字列は避ける
- T / G結合を考慮して、プライマー領域の一塩基がC or Tの両方の場合、プライマーに採用する塩基はAではなくGを使用、A or Gの場合、CではなくTを使用する
- プライマーのG / C含有量は40〜60%
- F・RプライマーのTmはほぼ同一にする
これらの工夫により、プライマー領域にミスマッチがあっても考慮しない場合より増幅しやすくなっているのではないでしょうか。
魚類メタバーコーディングプライマーの比較(淡水魚類群集)
MiFishプライマーに挟まれた超可変領域(以下、種判別領域)には、魚を識別するのに十分な情報がありますが、一部の種は近縁種と区別することが困難な場合があります。
では、実際のところ他の既存プライマーと比べて分解能や検出能力はどの程度なのでしょうか。
MiFishプライマーとecoPrimerの1つ(12SV5; Riaz et al. 2011)によって増幅された種判別領域のインシリコによる分類能力の比較をしました。
各プライマーの種判別領域はMiFishが平均で172bp、12SV5プライマーは平均で106bpです。両者を比較してみると、MiFishプライマーは12S5Vよりも塩基の多様性に富んでおり、分類能力が高いという事が分かりました。
Bylemans et al. 2018aでは、MiFishを含む8つの既存プライマーと新しく開発された7つのプライマーの分類能力、特異性、および分類範囲について評価しています。
計15のプライマーセットの中で一定の基準を満たすミトコンドリア12S rRNA遺伝子(MiFish-U / Teleo / AcMDB07)上に設計された3つのプライマーを使い、人工的に作成したDNAコミュニティと、自然河川に由来する2つのサンプルを対象に環境DNAメタバーコーディングを実施しました。
詳しい内容は原著論文に譲りますが、この結果、3つのプライマーペアにはそれぞれ利点と欠点があることがわかりました。
その後、同流域の河川魚群集をモニタリングした実証研究(Bylemans et al., 2018b)では、MiFishプライマーが分析に使用されていたことはMiFishプライマーの総合的なパフォーマンスが他のプライマーより優れていたことを示唆しています。
魚類メタバーコーディングプライマーの比較(淡水・海の魚類群集)
英国諸島の海洋および淡水魚の研究(Collins et al.2019)では、4つのミトコンドリア遺伝子(COI, cytb, 12S rRNA, 16S rRNA)に設計された12のプライマーセットを参照データベースのカバレッジ、プライマーの普遍性、分類能力について評価しました。
その結果、比較的高い評価を得られた、COIプライマーペア(Leray-XT、SeaDNA-mid、SeaDNA-short)と12Sプライマーペア(MiFish-U)を使って、イギリス海峡と北海周辺の5つの河口域と沿岸から得たサンプルで環境DNAメタバーコーディング分析に供しました。
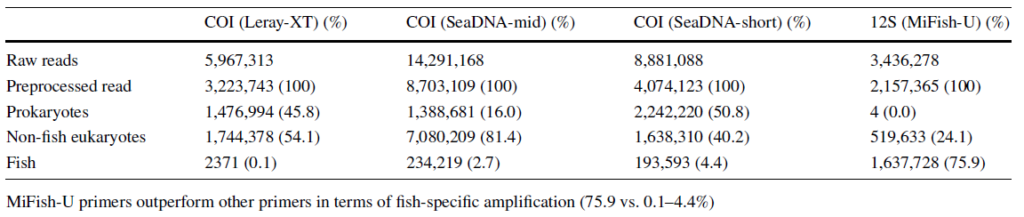
MiSeqによる配列決定とその後のバイオインフォマティクスによる解析では、MiFish-UプライマーはCOIプライマーと比較して、最終的に使用可能な魚リードが最も多く、またMiSeqから出力された生配列に対する魚類の配列の割合が最も高かった(COI; 0.1-4.4%, MiFish; 76%)(Table.1)。
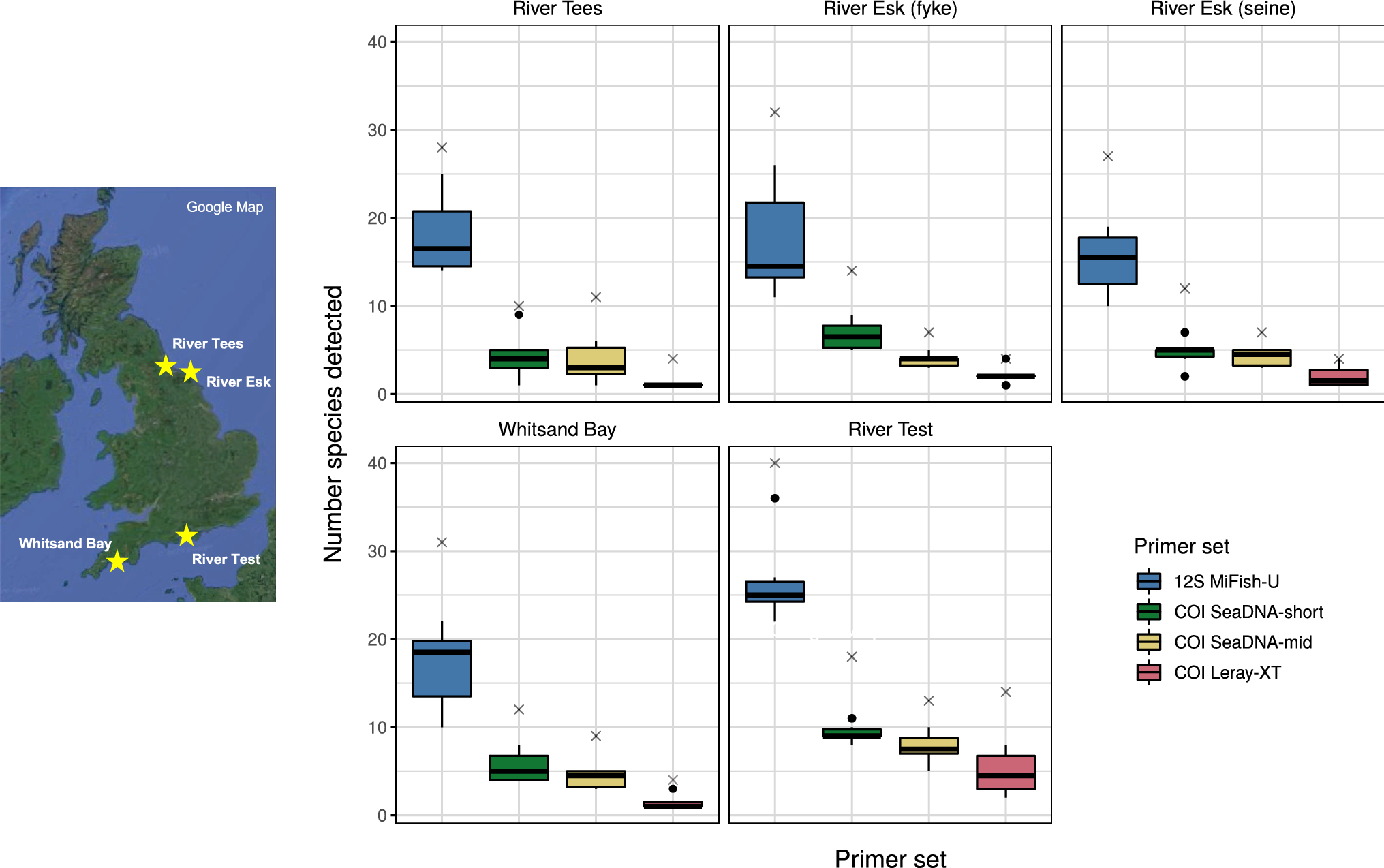
また、調査で生息が知られている魚種の61%しかMiFish-UのDNA増幅領域が登録されていなかったにもかかわらず、種の豊富さの推定値はすべてのサンプリングサイトで最も高い値を示しました(Fig.5)。
また、Collins et al.2019では、混合塩基の含まれるCOIプライマーを使用して、限定された分類群(魚など)の環境DNAメタバーコーディングを行うと、原核生物と非標的真核生物のDNA増幅により、大量の「無駄な」シーケンスが発生すると結論付けました。
Zhang et al.2020では、ミトコンドリアの12S rRNA、16S rRNA、cyt b、およびCOI遺伝子(それぞれ7, 6, 7および2プライマー)をターゲットとした22のプライマーセットにin silicoおよびin vitroの比較をしました。その結果、それぞれの各プライマーで増幅された分類学的な範囲、多様性、種の識別能力、群集構成は大きく異なっていました。
例えば、中国の北京の淡水域のサンプルからは0〜66種の魚類を検出しました。そして、魚種を多く検出することのできた上位6つのプライマーセットはすべて12S rRNA領域に作成されたプライマーで、そのうちMiFishを含むの4つのプライマーは優れた種多様性の検出能力を示していました。
Zhang et al., 2020はin silico PCRとin vitro試験の結果が常に一致するとは限らないことも見出しました。つまりユニバーサルプライマーの選択はin silicoによる評価のみに基づくべきではないと主張しています。
その理由として、PCRプライマーのin silico評価はプライマー/テンプレートの不一致のみを考慮し、プライマーのアニーリングを強化するような上記の技術的なコツに対応していない点が挙げられます(Ficetola et al. 2010; Elbrecht and Leese 2017; Taberlet et al. 2018)。
上記に挙げた3つのケーススタディでは、純淡水、河口域、沿岸の魚群集を対象とし、それぞれの群集は地球・赤道・大陸全体を通して著しく異なる分類学的構成を示していました。そして、これら3つの研究におけるMiFishプライマーの一貫した高い性能は、このプライマーペアの汎用性を示唆しています。
ですが、これらの研究は20〜60種の適度な種多様性を持つ温帯緯度地域で実施されています(Bylemans et al. 2018a; Collins et al. 2019; Zhang et al. 2020)。
より広範な分類学的および地理的スケールでMiFishプライマーの多様性を検証するには、より多様性が高い、低緯度の熱帯河川(Cilleros et al. 2019; Sales et al. 2019)やサンゴ礁(Oka et al. 2020)のような、検出種が100種を超える事が予想される水生生態系でプライマーの性能を評価する必要があると結論づけています。
和訳第一弾おわり
Reference
- Bylemans et al. 2018a
Toward an ecoregion scale evaluation of eDNA metabarcoding primers: a case study for the freshwater fish biodiversity of the MurrayDarling Basin (Australia). - Bylemans et al. 2018b
Monitoring riverine fish communities through eDNA metabarcoding: determining optimal sampling strategies along an altitudinal and biodiversity gradient. - Cilleros et al. 2019
Unlocking biodiversity and conservation studies in high-diversity environments using environmental DNA (eDNA): a test with Guianese freshwater fishes. - Collins et al. 2019
Non-specific amplification compromises environmental DNA metabarcoding with COI. - Elbrecht and Leese 2017
PrimerMiner: an r package for development and in silico validation of DNA metabarcoding primers. - Ficetola et al. 2010
An In silico approach for the evaluation of DNA barcodes. - Kitagawa et al.2020
Analysis for trial cases of environmental DNA metabarcoding to fish survey in the National Census on River Environments. - Miya et al. 2015
MiFish, a set of universal PCR primers for metabarcoding environmental DNA from fishes: detection of more than 230 subtropical marine species. - Oka et al. 2020
Environmental DNA metabarcoding for biodiversity monitoring of a highly-diverse tropical fish community in a coral-reef lagoon: Estimation of species richness and detection of habitat segregation. - Riaz et al. 2011
https ://doi.org/10.1093/nar/gkr73 2http://https ://doi.org/10.1093/nar/gkr73 2 - Sales et al. 2019
Influence of preservation methods, sample medium and sampling time on eDNA recovery in a neotropical river. - Taberlet et al. 2018
Environmental DNA: for biodiversity research and monitoring. - Zhang et al. 2020
A comprehensive and comparative evaluation of primers for metabarcoding eDNA from fish.








